一个硫原子有多少个电子 硫原子电子排布揭秘
- 生活
- 2025-08-04
- 115
一个硫原子有多少个电子?硫原子电子排布揭秘 大家好呀!今天咱们来聊聊一个听起来有点专业但其实超级有趣的话题——硫原子的电子数量。别被"电子排布"这个词吓到,我会用轻松的...
一个硫原子有多少个电子?硫原子电子排布揭秘
大家好呀!今天咱们来聊聊一个听起来有点专业但其实超级有趣的话题——硫原子的电子数量。别被"电子排布"这个词吓到,我会用轻松的方式带你了解这个微观世界的小秘密。
硫原子到底有多少个电子?
首先回答标题的一个硫原子有16个电子。没错,就是16个!这个数字可不是随便来的,它和硫的原子序数直接相关。在元素周期表上,硫的原子序数是16,这意味着它的原子核里有16个质子,而为了保持电中性,周围就必须有16个电子来平衡。

你可能要问:"为什么质子数和电子数要相等?"想象一下,质子带正电,电子带负电,如果数量不匹配,整个原子就会带电,那就不是我们常见的硫原子啦!
电子排布是怎么回事?
现在来说说电子排布。你可以把原子想象成一个微型太阳系,原子核是太阳,电子就像行星绕着太阳转。不过电子可不是随便乱跑的,它们有自己固定的"轨道"(专业术语叫电子层)。
硫原子的16个电子是这样分布的:
| 电子层 | 电子数量 |
|---|---|
| K层(层) | 2个 |
| L层(第二层) | 8个 |
| M层(第三层) | 6个 |
看到没?电子们是分层次居住的,而且每层能住的电子数量是有限的。层多2个,第二层多8个,第三层虽然理论上可以更多,但在硫原子这里只有6个。
为什么电子要这样排?
这就要提到一个叫"能量低原理"的概念了。电子和人类有点像,都喜欢待在舒适区。离原子核近的电子层能量低,电子们会优先占据这些位置。就像坐公交车,大家都想坐靠前的座位一样。
不过电子们也得遵守"泡利不相容原理"——每个座位(轨道)多只能坐两个电子,而且这两个电子还得自旋方向相反(可以理解为一个朝上一个朝下)。
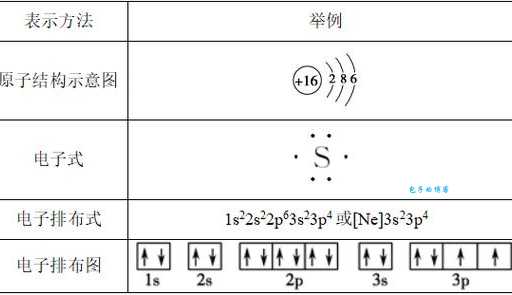
硫原子的电子排布式
如果你对化学有点兴趣,可能见过这样的写法:1s² 2s² 2p⁶ 3s² 3p⁴。别慌,我来解释一下:
1. 数字代表电子层(1=层,2=第二层)
2. 字母s,p代表电子亚层(可以理解为座位的不同类型)
3. 上标数字代表该亚层中的电子数
所以翻译过来就是:
1. 层s亚层有2个电子
2. 第二层s亚层有2个,p亚层有6个
3. 第三层s亚层有2个,p亚层有4个
加起来正好16个电子!硫原子外层的6个电子(3s²3p⁴)特别重要,决定了它的化学性质。
电子排布与硫的性质
硫原子外层有6个电子,离"满员"的8个还差2个,所以它特别容易和其他原子"交朋友"(形成化学键)。这就是为什么硫能形成那么多化合物,比如臭名昭著的硫化氢(臭鸡蛋味就是它),还有我们熟悉的硫酸。
硫原子可以:
1. 得到2个电子变成S²⁻离子
2. 与其他原子共享电子形成共价键
3. 在不同化合物中呈现多种化合价
这种灵活性让硫在自然界和工业中扮演着重要角色。
硫在生活中的应用
知道了硫的电子结构,就能理解为什么它这么有用了:
1. 橡胶工业:硫用于橡胶硫化,让橡胶更耐用
2. 农业:硫酸盐是重要的肥料成分
3. 医药:硫磺有杀菌作用,用于一些皮肤病药膏
4. 化工:硫酸是"化学工业之母",用途极其广泛
5. 食品:亚硫酸盐用作防腐剂(虽然现在用得少了)
你看,一个小小的16电子原子,竟然影响着我们生活的方方面面!
电子排布的记忆技巧
如果你需要记住硫的电子排布,可以试试这个顺口溜:
"硫十六电子排排坐,
一二层满十已过,
剩下六个外层,
化学反应全靠它!"
或者想象成:层住2个,第二层住8个,第三层住6个,就像一栋三层小楼,每层住户数量递减。
关于电子排布的常见误区
1. 电子不是真的在绕圈圈:现代量子力学告诉我们,电子位置只能用概率描述,没有固定轨道
2. 电子层数不等于周期数:虽然硫是第三周期元素,但它的电子占据三个主层
3. 电子不会相撞:量子特性保证了电子们能和平共处
4. 电子数可变:硫原子可以失去或获得电子变成离子,但中性硫原子永远是16个电子
硫与其他元素的比较
让我们看看硫和它邻居们的电子排布:
1. 磷(P):15个电子 - 2,8,5
2. 硫(S):16个电子 - 2,8,6
3. 氯(Cl):17个电子 - 2,8,7
4. 氩(Ar):18个电子 - 2,8,8
可以看到,同一周期的元素,随着原子序数增加,外层电子数逐渐增加。硫正好处于中间位置,既不像金属那样容易失去电子,也不像卤素那样容易得到电子。
动手画一画电子排布
建议你拿张纸画一画硫原子的电子排布示意图:
1. 画一个圆圈代表原子核,写上"16p+"(16个质子)
2. 画三个同心圆代表电子层
3. 在内层点2个点代表电子
4. 第二层均匀分布8个点
5. 外层画6个点
这样能帮助你更直观地理解电子排布。
硫的电子排布与化学反应
硫原子外层6个电子的配置,让它特别容易参与化学反应:
1. 与非金属反应时,倾向于获得2个电子达到稳定结构
2. 与金属反应时,可能失去部分电子形成共价键
3. 可以形成长链结构(比如多硫化物),因为它的原子大小和电子排布允许这种连接
这也是为什么硫能形成SO₂、SO₃、H₂S等多种多样的化合物。
总结
好啦,今天我们轻松愉快地了解了:
1. 硫原子有16个电子
2. 这些电子分层排列:2,8,6
3. 外层6个电子决定了硫的化学性质
4. 这种电子排布让硫在自然界和工业中如此重要
记住,虽然原子世界很小,但规律却非常美妙。硫原子就像一个有着16个孩子的大家庭,孩子们按照规则住在不同的楼层,共同维持着这个微小世界的平衡。
你有没有想过,如果硫原子的电子数多一个或少一个,会变成什么元素呢?或者你在生活中有没有注意到哪些物品或现象与硫的特性有关?欢迎分享你的想法!